lunes, 17 de octubre de 2011
sábado, 15 de octubre de 2011
Quimica Tercer Periodo
Los Métodos de Separación se basan en diferencias entre las propiedades físicas de los componentes de una mezcla, tales como: Punto de EbulliciónDensidad,, Presión de Vapor, Punto de Fusión, Solubilidad, etc. Los Métodos más conocidos son:
Filtración
El procedimiento de Filtración consiste en retener partículas sólidas por medio de una barrera, la cual puede consistir de mallas, fibras, material poroso o un relleno sólido.
El procedimiento de Filtración consiste en retener partículas sólidas por medio de una barrera, la cual puede consistir de mallas, fibras, material poroso o un relleno sólido.
Decantación
El procedimiento de Decantación consiste en separar componentes que contienen diferentes fases (por ejemplo, 2 líquidos que no se mezclan, sólido y líquido, etc.) siempre y cuando exista una diferencia significativa entre las densidades de las fases.
La Separación se efectúa vertiendo la fase superior (menos densa) o la inferior (más densa).
El procedimiento de Decantación consiste en separar componentes que contienen diferentes fases (por ejemplo, 2 líquidos que no se mezclan, sólido y líquido, etc.) siempre y cuando exista una diferencia significativa entre las densidades de las fases.
La Separación se efectúa vertiendo la fase superior (menos densa) o la inferior (más densa).
Evaporación
El procedimiento de Evaporación consiste en separar los componentes mas volátiles exponiendo una gran superficie de la mezcla. El aplicar calor y una corriente de aire seco acelera el proceso.
El procedimiento de Evaporación consiste en separar los componentes mas volátiles exponiendo una gran superficie de la mezcla. El aplicar calor y una corriente de aire seco acelera el proceso.
Cristalización
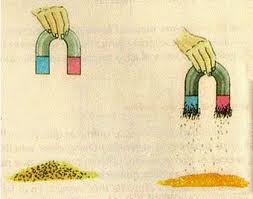
Una Solución consta de dos componentes: El Disolvente y el Soluto. Las Soluciones pueden ser No-Saturadas, Saturadas y Sobre-Saturadas (Para ver un gráfico representando soluciones No-Saturadas, Saturadas y Sobre-Saturadas .
Las Soluciones No-Saturadas tienen una concentracion de soluto menor que las soluciones saturadas, y éstas a su vez tienen una concentración de solucto menor que una solución sobresaturada. Por ejemplo: Supóngase que se agregan unos cuantos cristales de Sal Común a un Vaso de Agua. Esta será una Solución No-Saturada. Si se sigue añadiendo Sal con agitación se llegará hasta un punto en el cual los cristales ya no se disuelven. Esta será una Solución Sobre-Saturada. Si esta solución se deja reposar y se remueven los cristales que no se disolvieron, se obtendrá una Solución Saturada que contendrá la cantidad máxima de soluto que se puede disolver a la temperatura actual que llamaremos inicial (Ver Solubilidad). Si enfriamos la solución Saturada, con el tiempo se formarán cristales de Sal, ésto se debe a que la solubilidad de la Sal en el Agua depende de la Temperatura y lo que fue una solución saturada a la temperatura inicial es ahora una solución sobre-saturada a la temperatura final. Es importante recalcar que una solución sobresaturada es un sistema metaestable y que tenderá a estabilizarse, mientras que una solución saturada es un sistema estable.
Para efectuar la Cristalización de un Sólido hay que partir de una Solución Sobre-Saturada. Existen varias formas de Sobre-Saturar una Solución, una de ellas es el enfriamiento de la solución, otra consiste en eliminar parte del Disolvente (Por ejemplo: por evaporación) a fin de aumentar la concentración del soluto, otra forma consiste en añadir un tercer componente que tenga una mayor solubilidad que el componente que se desea cristalizar.
La rapidez del Enfriamiento definirá el tamaño de los cristales resultantes. Un enfriamiento rápido producirá cristales pequeños, mientras que un enfriamiento lento producirá cristales grandes. Para acelerar la Cristalización puede hacerse una "siembra" raspando las paredes del recipiente.
Una Solución consta de dos componentes: El Disolvente y el Soluto. Las Soluciones pueden ser No-Saturadas, Saturadas y Sobre-Saturadas (Para ver un gráfico representando soluciones No-Saturadas, Saturadas y Sobre-Saturadas .
Las Soluciones No-Saturadas tienen una concentracion de soluto menor que las soluciones saturadas, y éstas a su vez tienen una concentración de solucto menor que una solución sobresaturada. Por ejemplo: Supóngase que se agregan unos cuantos cristales de Sal Común a un Vaso de Agua. Esta será una Solución No-Saturada. Si se sigue añadiendo Sal con agitación se llegará hasta un punto en el cual los cristales ya no se disuelven. Esta será una Solución Sobre-Saturada. Si esta solución se deja reposar y se remueven los cristales que no se disolvieron, se obtendrá una Solución Saturada que contendrá la cantidad máxima de soluto que se puede disolver a la temperatura actual que llamaremos inicial (Ver Solubilidad). Si enfriamos la solución Saturada, con el tiempo se formarán cristales de Sal, ésto se debe a que la solubilidad de la Sal en el Agua depende de la Temperatura y lo que fue una solución saturada a la temperatura inicial es ahora una solución sobre-saturada a la temperatura final. Es importante recalcar que una solución sobresaturada es un sistema metaestable y que tenderá a estabilizarse, mientras que una solución saturada es un sistema estable.
Para efectuar la Cristalización de un Sólido hay que partir de una Solución Sobre-Saturada. Existen varias formas de Sobre-Saturar una Solución, una de ellas es el enfriamiento de la solución, otra consiste en eliminar parte del Disolvente (Por ejemplo: por evaporación) a fin de aumentar la concentración del soluto, otra forma consiste en añadir un tercer componente que tenga una mayor solubilidad que el componente que se desea cristalizar.
La rapidez del Enfriamiento definirá el tamaño de los cristales resultantes. Un enfriamiento rápido producirá cristales pequeños, mientras que un enfriamiento lento producirá cristales grandes. Para acelerar la Cristalización puede hacerse una "siembra" raspando las paredes del recipiente.
g/mL = gramos por mililitro
g/L = gramos por litro
p.p.m. = partes por millón = mg/L, mg/kg, mL/L.
% P = (gramos de soluto)*(100)/ (gramos de Solución)
% V = (mL de soluto)*(100)/(mL de Solución)
% P/V = (gramos de soluto)*(100)/(mL de Solución)
M = Molaridad = moles/L
N = Normalidad = # equivalentes/L
X = Fracción Mol = moles de soluto/moles totales
g/L = gramos por litro
p.p.m. = partes por millón = mg/L, mg/kg, mL/L.
% P = (gramos de soluto)*(100)/ (gramos de Solución)
% V = (mL de soluto)*(100)/(mL de Solución)
% P/V = (gramos de soluto)*(100)/(mL de Solución)
M = Molaridad = moles/L
N = Normalidad = # equivalentes/L
X = Fracción Mol = moles de soluto/moles totales
sobresaturada
Se dice que una solución está sobresaturada cuando contiene más soluto que la cantidad soportada en condiciones de equilibrio por el disolvente, a una temperatura dada. Es por lo tanto una solución inestable, en la cual el exceso disuelto de depositará, aqui el factor temperatura es importante ya que no habrá remanente en caso la temperatura aumente lo suficiente como aumentar la solubilidad.
la solubilidad se mide en moles sobre litro, o gramos sobre litro, digamos... sal y agua, sal es el soluto y agua el solvente cierto? ok, que su solubilidad sea 250 gramos por cada litro a 25ºC entre el agua y la sal, 250 g/L nos indica que un litro de agua diluye 250 gramos de sal, ya, esa cantidad es lo maximo en gramos que puede solubilizar el agua a esa temperatura, si en 1000 ml de agua, que es un litro, agregas 251 gramos, por ese gramo en que se excede la solucion, ES SOBRESATURADA, porque ese gramo excedente no se va a disolver, sino va a quedar como un remanente. Ese es el concepto de solución sobresaturada, ahora si aumentas la temperatura, seguramente la solubilidad va a incrementarse, es decir, ya no va a ser 250 gramos (el supuesto) sino 280 300 gramos por litro.

la solubilidad se mide en moles sobre litro, o gramos sobre litro, digamos... sal y agua, sal es el soluto y agua el solvente cierto? ok, que su solubilidad sea 250 gramos por cada litro a 25ºC entre el agua y la sal, 250 g/L nos indica que un litro de agua diluye 250 gramos de sal, ya, esa cantidad es lo maximo en gramos que puede solubilizar el agua a esa temperatura, si en 1000 ml de agua, que es un litro, agregas 251 gramos, por ese gramo en que se excede la solucion, ES SOBRESATURADA, porque ese gramo excedente no se va a disolver, sino va a quedar como un remanente. Ese es el concepto de solución sobresaturada, ahora si aumentas la temperatura, seguramente la solubilidad va a incrementarse, es decir, ya no va a ser 250 gramos (el supuesto) sino 280 300 gramos por litro.
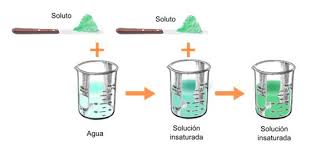
insaurada
ES UNA SOLUCION EN LA QUE EL SOLUTO NO LLEGO A SU CONCENTRACION MAXIMA,OSEA A SU CONCENTRACION DE SATURACION.
OSEA QUE ES UNA SOLUCION EN LA CUAL TODABIA ADMITE QUE SE SIGA SOLUBILIZANDO EL SOLUTO SIN QUE APAREZCAN PRESIPITADOS
Una solucion insaturada se obtiene cuando agregamos una cantidad de soluto (lo que se va a disolver) en una pequeña cantidad al solvente (lo que va a disolver), de modo tal que si deseamos adicionar mas adelante mas soluto al solvente este va a disolverse
Un ejemplo sencillo lo podemos ver cuando tenemos una jarra grande de agua y le adicionamos una cucharada de sal (con una cuchara de postre) y lo agitamos, se puede observar que la sal se disuelve sin ningun problema y que podemos adicionarle varias cucharadas mas; el agua tiene la capacidad de disolver una cantidad determinada de sal, o cualquier otro soluto, y esto esta determinado por la solubilidad de esa sustancia en ese solvente; o sea, la solubilidad de la sal en el agua nos dice la cantidad maxima de sal que podemos agregar a una cantidad de agua sin que nos quede sal en sin disolver.
OSEA QUE ES UNA SOLUCION EN LA CUAL TODABIA ADMITE QUE SE SIGA SOLUBILIZANDO EL SOLUTO SIN QUE APAREZCAN PRESIPITADOS
Una solucion insaturada se obtiene cuando agregamos una cantidad de soluto (lo que se va a disolver) en una pequeña cantidad al solvente (lo que va a disolver), de modo tal que si deseamos adicionar mas adelante mas soluto al solvente este va a disolverse
Un ejemplo sencillo lo podemos ver cuando tenemos una jarra grande de agua y le adicionamos una cucharada de sal (con una cuchara de postre) y lo agitamos, se puede observar que la sal se disuelve sin ningun problema y que podemos adicionarle varias cucharadas mas; el agua tiene la capacidad de disolver una cantidad determinada de sal, o cualquier otro soluto, y esto esta determinado por la solubilidad de esa sustancia en ese solvente; o sea, la solubilidad de la sal en el agua nos dice la cantidad maxima de sal que podemos agregar a una cantidad de agua sin que nos quede sal en sin disolver.
saturada
- En química, un compuesto saturado está formado por moléculas orgánicas que no contienen dobles enlaces ni triples enlaces carbono-carbono. Se piensa que la saturación de las grasas determina su capacidad de bloquear el sistema circulatorio de la sangre en el cuerpo.
- Una disolución saturada es la que contiene la mayor concentración de soluto posible en un volumen de disolvente dado y para cierta temperatura. Unasolución sobresaturada contiene más soluto del que puede ser disuelto en el disolvente a esa temperatura; normalmente se consigue al bajar la temperatura o por evaporación del disolvente en una solución saturada. En este caso, la adición de cristales de soluto puede provocar su precipitado.
Cuando una solución contiene "disuelto" más soluto del que puede disolver se dice que esta solución es una solución sobresaturada, la cual no es estable.
Un ejemplo de solución saturada es una solución de 37.5 gramos de NaCl(sal común) en 100 gramos de agua a 0ºC Cuando una solución contiene disuelto menos soluto del que puede disolver el solvente se dice que esta solución es no saturada.
Espero sea de utilidad!
El Agua Y Las Soluciones

La estequiometría es una parte de la Química encargada de estudiar las relaciones que existen entre las masas y volúmenes de las sustancias que participan en las reacciones químicas. Este tema implica la formulación y solución de problemas. Para poder resolver estos problemas, necesitamos conocer algunos conceptos fundamentales y sus aplicaciones.
El propósito de esta lección es conocer estos conceptos fundamentales que son los siguientes: peso atómico, átomo-gramo, peso molecular, mol, peso equivalente de un elemento y de un compuesto.
PESO ATÓMICO DE UN ELEMENTO QUÍMICO.- (P.at.) Como quiera que los elementos químicos son generalmente una mezcla de sus isótopos, es que debemos entender que todos los átomos que le constituyen no tienen la misma masa y por tanto el mismo peso; sin embargo, todos sabemos que a cada elemento químico le corresponde un peso atómico determinado, que no es sino el peso promedio de sus isótopos teniendo en cuenta sus porcentajes de abundancia en la naturaleza.
Según esta idea el peso atómico de un elemento se podría determinar con la siguiente fórmula, si se conocen las masas de cada uno de sus isótopos y los porcentajes de abundancia de cada uno de ellos:
El propósito de esta lección es conocer estos conceptos fundamentales que son los siguientes: peso atómico, átomo-gramo, peso molecular, mol, peso equivalente de un elemento y de un compuesto.
PESO ATÓMICO DE UN ELEMENTO QUÍMICO.- (P.at.) Como quiera que los elementos químicos son generalmente una mezcla de sus isótopos, es que debemos entender que todos los átomos que le constituyen no tienen la misma masa y por tanto el mismo peso; sin embargo, todos sabemos que a cada elemento químico le corresponde un peso atómico determinado, que no es sino el peso promedio de sus isótopos teniendo en cuenta sus porcentajes de abundancia en la naturaleza.
Según esta idea el peso atómico de un elemento se podría determinar con la siguiente fórmula, si se conocen las masas de cada uno de sus isótopos y los porcentajes de abundancia de cada uno de ellos:

Sin embargo, en todas las tablas periódicas, donde se consignan las características de los diferentes elementos químicos figuran los pesos atómicos relativos de los elementos químicos que se determinaron tomando como término de comparación a un isótopo del carbono que es el carbono-12.
El peso atómico relativo de un elemento se puede definir como el peso de dicho elemento que resulta de compararlo con la doceava parte del carbono-12 (C-12) al que por convención se le ha asignado el peso de 12,0000 uma (unidades de masa atómica).
Cada elemento químico se caracteriza por poseer un peso atómico concreto.
H = 1,008 .........................Cl = 35,453
C = 12,011 ........................Na = 22,9897
O = 15,9994 .....................S = 32,06
N = 14,0067 .....................Fe = 55,847
El peso atómico relativo de un elemento se puede definir como el peso de dicho elemento que resulta de compararlo con la doceava parte del carbono-12 (C-12) al que por convención se le ha asignado el peso de 12,0000 uma (unidades de masa atómica).
Cada elemento químico se caracteriza por poseer un peso atómico concreto.
H = 1,008 .........................Cl = 35,453
C = 12,011 ........................Na = 22,9897
O = 15,9994 .....................S = 32,06
N = 14,0067 .....................Fe = 55,847
Balanceo
Las ecuaciones químicas permiten conocer cuales son las sustancias que se combinan para formar productos, esto quiere decir las que se forman. La representación de una ecuación es por medio de la ecuación química, la cual esta constituida por reactivos y productos separados por una flecha. En la ecuación química el número de reactivos que se obtiene debe de ser la misma cantidad que de productos.
Balancear una ecuación es buscar que el número de átomos en el primer miembro con los del segundo se obtenga una igualdad por lo que es importante el uso de coeficientes, pero nunca se deberá alterar los subíndices.
BALANCEO DE ECUACIONES QUIMICAS POR EL METODO DE TANTEO
Para el balanceo de ecuaciones por el método de tanteo es importante conocer la Ley de la conservación de la masa que se enuncia del siguiente modo:En una reacción química, la suma de las masa de las sustancias reaccionantes es igual a la suma de las masas de los productos de la reacción.
Para igualar ecuaciones por este método han de compararse uno a uno los distintos elementos que figuran en la reacción. Si un elemento cualquiera, X, figura, por ejemplo, en el primer miembro con el subíndice 2 y en el segundo con 1, entonces, en principio, se ha de colocar el coeficiente 2 a la izquierda de la formula de segundo miembro que contiene el elemento X. Tal proceder se sigue sistemáticamente con los restantes elementos lo que obliga a veces a modificar alguno de los coeficientes ya escritos.
Igualase, por ejemplo, la reacción:
H2 + O2 H2O
El hidrogeno ya esta igualado, para ajustar el oxigeno es necesario colocar el coeficiente 2 a la molécula de H2O.
H2 + O2 2H2O
El balance, puesto que el coeficiente 2 afecta tanto al H como al O del agua, se deberá añadir el coeficiente 2 al H2 del primer miembro.
2H2 + O2 2H2O
Al establecer la misma cantidad de masa de los reactivos como en los productos se dice que la ecuación esta balanceada.
BALANCEO DE ECUACIONES QUIMICAS POR EL METODO DE OXIDO-REDUCCION
En el método de oxido reducción, también conocido como Redox, intervienen dos fenómenos. La oxidación y la reducción. La oxidación es la cesión de electrones por parte de los átomos de un elemento y la reducción es la ganancia de electrones.Para el balanceo por este método es importante conocer el Numero de oxidación este numero de un elemento representa su grado de oxidación = numero de electrones perdidos.
Para utilizar este método se siguen los siguientes pasos:
Quimica Sengudo periodo
Doble Situacion
reaccion simple es cuanod se unen 2 elementos para formar uno
y sustitucion doble es cuando 2 moleculas intercambian un elemneto entre si para formar otra molecula Reacciones de simple sustitución:
Denominadas también de simple desplazamiento cuando una sustancia simple reacciona con otra compuesta, reemplazando a uno de sus componentes.
Sustitución simple. Se forma por intercambio de iones entre dos compuestos
Cu + Ag NO3 Cu NO3 + Ag
El cobre sustituye la plata
Reacciones de doble sustitución:
También se denominan de doble desplazamiento o metátesis y ocurren cuando hay intercambio de elementos entre dos compuestos diferentes y de esta manera originan nuevas sustancias. * Se presentan cuando las sustancias reaccionantes están en estado iónico por encontrarse en solución, combinándose entre sí sus iones con mucha facilidad, para formar sustancias que permanecen estables en el medio reaccionante:
Doble sustitución, Se forma por intercambio de iones o radicales entre dos compuestos
Intercambian sus lugares
Ba O2 + H2 SO4 Ba SO4 + H2O2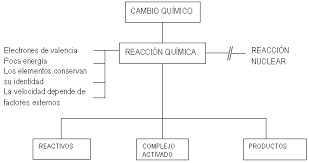
reaccion simple es cuanod se unen 2 elementos para formar uno
y sustitucion doble es cuando 2 moleculas intercambian un elemneto entre si para formar otra molecula Reacciones de simple sustitución:
Denominadas también de simple desplazamiento cuando una sustancia simple reacciona con otra compuesta, reemplazando a uno de sus componentes.
Sustitución simple. Se forma por intercambio de iones entre dos compuestos
Cu + Ag NO3 Cu NO3 + Ag
El cobre sustituye la plata
Reacciones de doble sustitución:
También se denominan de doble desplazamiento o metátesis y ocurren cuando hay intercambio de elementos entre dos compuestos diferentes y de esta manera originan nuevas sustancias. * Se presentan cuando las sustancias reaccionantes están en estado iónico por encontrarse en solución, combinándose entre sí sus iones con mucha facilidad, para formar sustancias que permanecen estables en el medio reaccionante:
Doble sustitución, Se forma por intercambio de iones o radicales entre dos compuestos
Intercambian sus lugares
Ba O2 + H2 SO4 Ba SO4 + H2O2
Ecuaciones quimicas
Una ecuación química es una descripción simbólica de una reacción química. Muestra las sustancias que reaccionan (reactivos o reactantes) y las sustancias o productos que se obtienen. También nos indican las cantidades relativas de las sustancias que intervienen en la reacción. Las ecuaciones químicas son el modo de representarlas.
Se utilizan para describir lo que sucede en una reacción química en sus estados inicial y final. En ella figuran dos miembros; en el primero, los símbolos o fórmulas de los reactantes, reaccionantes o reactivos y en el segundo los símbolos o fórmulas de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción.
Quimica Primer periodo
Materia y Energia
Todo lo que nos rodea, incluidos nosotros mismos, está formado por un componente común: la materia. Normalmente, para referinos a los objetos usamos términos como materia, masa, peso, volumen. Para clarificar los conceptos, digamos que:
Todo lo que nos rodea, incluidos nosotros mismos, está formado por un componente común: la materia. Normalmente, para referinos a los objetos usamos términos como materia, masa, peso, volumen. Para clarificar los conceptos, digamos que:
Materia es todo lo que tiiene masa y ocupa un lugar en el espacio;
Masa es la cantidad de materia que tiene un cuerpo;
Volumen es el espacio ocupado por la masa
Cuerpo es una porción limitada de materia
Estados físicos de la materia
En términos conceptuales, materia se puede definir como cualquier sustancia que posee masa y ocupa un lugar en el espacio (volumen); la cual como cualquier otro componente de la naturaleza reacciona a factores ambientales como la presión y la temperatura, manifestándose en tres estados:
· Gaseoso.
· Líquido.
· Sólido.
Estos estados obedecen fundamentalmente a la energía cinética o energía de movimiento de las moléculas que conforman dicha materia y a la forma de agregación de las mismas.
Los estados de la materia dependen de Factores del ambiente como presión y temperatura. | 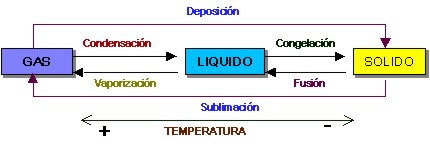 |
Estados de la materia en relación a cambios de la temperatura del ambiente
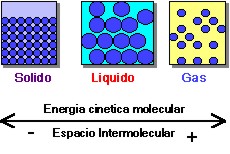 | Los diferentes estados de la materia se caracterizan por la energía cinética de las moléculas y los espacios existentes entre estas. |
Estados de la materia en relación a cambios de la energía cinética de las moléculas
Cada uno de los estados le confiere a la materia características propias, a pesar de no cambiar su composición.
La figura siguiente complementa los conceptos aquí formulados, obsérvelo haciendo énfasis en las relaciones y diferentes vías existentes:
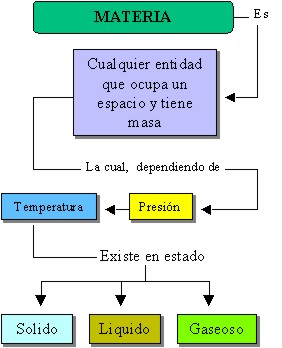 |
Funiones inorganicas
La quimica inorganica incluye la materia no viviente como los metales, los no metales y las diversas combinaciones entre dichos elementos.
Los compuestos inorganicos se agrupan segun la forma en que se combian, lo cual determina su comportamiento y caracteristicas similares. Cada agrupacion de dichos compuestos se conoce con el nombre de funcion quimica. La funciones quimicas presentan un atomo o grupo de atomos que las diferencia entre si. Dichas funciones, para la quimica inorganica son 4: oxido,hidroxido,acido y sal.
Para escribir la formula de los oxidos, acidos y sales se acostumbran poner los simbolos de los elementod que lo componen en orden, segun su electronegatividad: el menos electronegativo a la izquierda y el mas electronegativo a al derecha. Otro criterio ha sido escribir a la izquierda el ion positivo (cation) y a la derecha el ion negativo (anion)
Las principales funciones inórganicas son:
FUNCION OXIDO: son compuestos formados por la combinacion del oxigeno con otro elemento. se escribe primero el simbolo del elemento diferente del oxigeno y luego el simbolo del oxigeno. ejemplo: Be+O = BeO
clases de oxidos:
Oxidos Basicos: son oxidos formados por un metal y oxigeno que al reaccionar con agua producen hidroxidos. ZnO, MgO.
oxidos acidos: son oxidos formados por un no metal y oxigeno. ejemplo: CO2, SO2, NO2.
FUNCION HIDROXIDO O BASE: una base es un compuesto que al disociarse con el agua produce iones OH-. ejemplo: NaOH= Na+ + OH-.
FUNCION ACIDO:los acidos son sustancias que al disolverse en agua producen iones positivos H+ de hidrogeno. ejemplo: HCl + H2O = H3O+ + Cl-
tipos de acidos:
acidos hidracidos: son combinaciones del hidrogeno con los halogenos (fluor cloro . etc)
ejemplo: HF(acido fluorhidrico) HCl(acido clorhidrico)
acidos oxacidos: son compuestos formados a partir de los oxidos acidos o de los no metales cuando se combianan con el agua. ejemplo: N2O3+H2O produce: H2N2O4= HNO2
SALES: tanto para su nomenclatura como para su formacion las sales se dividen en :
sales neutras:no contienen hidrogenos, todos han sido reemplazados por elementos metalicos ejemplo: KClO, AgNO3.
sales acidas: contiene hidrogenos ejemplo: KHPO4: fosfato monopotasico.
sales basicas: resultan de sustituir en un abase , parcialmente, los grupos OH.
ejemplo: CuOHNO3: Cu(OH)2 + HNO3 produce: H2O + CuOHNO3 nitrato basico de cobre.
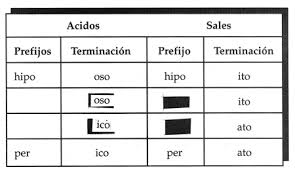
Los compuestos inorganicos se agrupan segun la forma en que se combian, lo cual determina su comportamiento y caracteristicas similares. Cada agrupacion de dichos compuestos se conoce con el nombre de funcion quimica. La funciones quimicas presentan un atomo o grupo de atomos que las diferencia entre si. Dichas funciones, para la quimica inorganica son 4: oxido,hidroxido,acido y sal.
Para escribir la formula de los oxidos, acidos y sales se acostumbran poner los simbolos de los elementod que lo componen en orden, segun su electronegatividad: el menos electronegativo a la izquierda y el mas electronegativo a al derecha. Otro criterio ha sido escribir a la izquierda el ion positivo (cation) y a la derecha el ion negativo (anion)
Las principales funciones inórganicas son:
FUNCION OXIDO: son compuestos formados por la combinacion del oxigeno con otro elemento. se escribe primero el simbolo del elemento diferente del oxigeno y luego el simbolo del oxigeno. ejemplo: Be+O = BeO
clases de oxidos:
Oxidos Basicos: son oxidos formados por un metal y oxigeno que al reaccionar con agua producen hidroxidos. ZnO, MgO.
oxidos acidos: son oxidos formados por un no metal y oxigeno. ejemplo: CO2, SO2, NO2.
FUNCION HIDROXIDO O BASE: una base es un compuesto que al disociarse con el agua produce iones OH-. ejemplo: NaOH= Na+ + OH-.
FUNCION ACIDO:los acidos son sustancias que al disolverse en agua producen iones positivos H+ de hidrogeno. ejemplo: HCl + H2O = H3O+ + Cl-
tipos de acidos:
acidos hidracidos: son combinaciones del hidrogeno con los halogenos (fluor cloro . etc)
ejemplo: HF(acido fluorhidrico) HCl(acido clorhidrico)
acidos oxacidos: son compuestos formados a partir de los oxidos acidos o de los no metales cuando se combianan con el agua. ejemplo: N2O3+H2O produce: H2N2O4= HNO2
SALES: tanto para su nomenclatura como para su formacion las sales se dividen en :
sales neutras:no contienen hidrogenos, todos han sido reemplazados por elementos metalicos ejemplo: KClO, AgNO3.
sales acidas: contiene hidrogenos ejemplo: KHPO4: fosfato monopotasico.
sales basicas: resultan de sustituir en un abase , parcialmente, los grupos OH.
ejemplo: CuOHNO3: Cu(OH)2 + HNO3 produce: H2O + CuOHNO3 nitrato basico de cobre.
Cambios Fisicos Y Quimicos
CAMBIOS FISICOS: En unos casos la materia no cambia de naturaleza, sigue siendo igual antes de la transformación que después de ella. Así, el agua que estaba en el charco se evapora pasando al aire, donde sigue siendo agua, que volverá al charco en forma líquida cuando llueva.
Los cambios en los que no hay variación en la naturaleza de la materia, en los que la sustancia inicial es la misma que la final, se llaman cambios físicos.
Ejemplos de cambios físicos son los cambios de estado, forma, tamaño, lugar, velocidad...
CAMBIOS QUIMICOS: Un cambio químico es una transformación en la naturaleza de la materia; es decir, una o varias sustancias se transforman en otra u otras diferentes.
Ejemplos de cambios químicos son las combustiones, oxidaciones o descomposiciones.
En un cambio químico se produce una transformación de la materia; es decir, una o varias sustancias se transforman en otra u otras diferentes.
Los cambios químicos se describen por una reacción química.
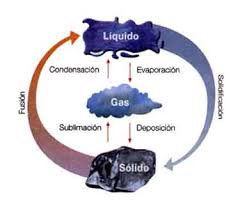

Los cambios en los que no hay variación en la naturaleza de la materia, en los que la sustancia inicial es la misma que la final, se llaman cambios físicos.
Ejemplos de cambios físicos son los cambios de estado, forma, tamaño, lugar, velocidad...
CAMBIOS QUIMICOS: Un cambio químico es una transformación en la naturaleza de la materia; es decir, una o varias sustancias se transforman en otra u otras diferentes.
Ejemplos de cambios químicos son las combustiones, oxidaciones o descomposiciones.
En un cambio químico se produce una transformación de la materia; es decir, una o varias sustancias se transforman en otra u otras diferentes.
Los cambios químicos se describen por una reacción química.

Unidades Derivadas
Las unidades derivadas son parte del Sistema Internacional de Unidades y se derivan de las unidades básicas que son:
- metro (m), unidad de longitud
- kilogramo (kg), unidad de masa
- segundo (s), unidad de tiempo
- amperio (A), unidad de intensidad de corriente eléctrica
- kelvin (K), unidad de temperatura
- mol (mol), unidad de cantidad de sustancia
- candela (cd), unidad de intensidad luminosa
De las cuales se obtienen:
]Unidades derivadas que tienen nombre propio
Suscribirse a:
Entradas (Atom)
