Quimica
lunes, 17 de octubre de 2011
sábado, 15 de octubre de 2011
Quimica Tercer Periodo
Los Métodos de Separación se basan en diferencias entre las propiedades físicas de los componentes de una mezcla, tales como: Punto de EbulliciónDensidad,, Presión de Vapor, Punto de Fusión, Solubilidad, etc. Los Métodos más conocidos son:
Filtración
El procedimiento de Filtración consiste en retener partículas sólidas por medio de una barrera, la cual puede consistir de mallas, fibras, material poroso o un relleno sólido.
El procedimiento de Filtración consiste en retener partículas sólidas por medio de una barrera, la cual puede consistir de mallas, fibras, material poroso o un relleno sólido.
Decantación
El procedimiento de Decantación consiste en separar componentes que contienen diferentes fases (por ejemplo, 2 líquidos que no se mezclan, sólido y líquido, etc.) siempre y cuando exista una diferencia significativa entre las densidades de las fases.
La Separación se efectúa vertiendo la fase superior (menos densa) o la inferior (más densa).
El procedimiento de Decantación consiste en separar componentes que contienen diferentes fases (por ejemplo, 2 líquidos que no se mezclan, sólido y líquido, etc.) siempre y cuando exista una diferencia significativa entre las densidades de las fases.
La Separación se efectúa vertiendo la fase superior (menos densa) o la inferior (más densa).
Evaporación
El procedimiento de Evaporación consiste en separar los componentes mas volátiles exponiendo una gran superficie de la mezcla. El aplicar calor y una corriente de aire seco acelera el proceso.
El procedimiento de Evaporación consiste en separar los componentes mas volátiles exponiendo una gran superficie de la mezcla. El aplicar calor y una corriente de aire seco acelera el proceso.
Cristalización
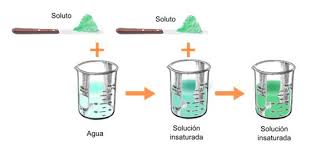
Una Solución consta de dos componentes: El Disolvente y el Soluto. Las Soluciones pueden ser No-Saturadas, Saturadas y Sobre-Saturadas (Para ver un gráfico representando soluciones No-Saturadas, Saturadas y Sobre-Saturadas .
Las Soluciones No-Saturadas tienen una concentracion de soluto menor que las soluciones saturadas, y éstas a su vez tienen una concentración de solucto menor que una solución sobresaturada. Por ejemplo: Supóngase que se agregan unos cuantos cristales de Sal Común a un Vaso de Agua. Esta será una Solución No-Saturada. Si se sigue añadiendo Sal con agitación se llegará hasta un punto en el cual los cristales ya no se disuelven. Esta será una Solución Sobre-Saturada. Si esta solución se deja reposar y se remueven los cristales que no se disolvieron, se obtendrá una Solución Saturada que contendrá la cantidad máxima de soluto que se puede disolver a la temperatura actual que llamaremos inicial (Ver Solubilidad). Si enfriamos la solución Saturada, con el tiempo se formarán cristales de Sal, ésto se debe a que la solubilidad de la Sal en el Agua depende de la Temperatura y lo que fue una solución saturada a la temperatura inicial es ahora una solución sobre-saturada a la temperatura final. Es importante recalcar que una solución sobresaturada es un sistema metaestable y que tenderá a estabilizarse, mientras que una solución saturada es un sistema estable.
Para efectuar la Cristalización de un Sólido hay que partir de una Solución Sobre-Saturada. Existen varias formas de Sobre-Saturar una Solución, una de ellas es el enfriamiento de la solución, otra consiste en eliminar parte del Disolvente (Por ejemplo: por evaporación) a fin de aumentar la concentración del soluto, otra forma consiste en añadir un tercer componente que tenga una mayor solubilidad que el componente que se desea cristalizar.
La rapidez del Enfriamiento definirá el tamaño de los cristales resultantes. Un enfriamiento rápido producirá cristales pequeños, mientras que un enfriamiento lento producirá cristales grandes. Para acelerar la Cristalización puede hacerse una "siembra" raspando las paredes del recipiente.
Una Solución consta de dos componentes: El Disolvente y el Soluto. Las Soluciones pueden ser No-Saturadas, Saturadas y Sobre-Saturadas (Para ver un gráfico representando soluciones No-Saturadas, Saturadas y Sobre-Saturadas .
Las Soluciones No-Saturadas tienen una concentracion de soluto menor que las soluciones saturadas, y éstas a su vez tienen una concentración de solucto menor que una solución sobresaturada. Por ejemplo: Supóngase que se agregan unos cuantos cristales de Sal Común a un Vaso de Agua. Esta será una Solución No-Saturada. Si se sigue añadiendo Sal con agitación se llegará hasta un punto en el cual los cristales ya no se disuelven. Esta será una Solución Sobre-Saturada. Si esta solución se deja reposar y se remueven los cristales que no se disolvieron, se obtendrá una Solución Saturada que contendrá la cantidad máxima de soluto que se puede disolver a la temperatura actual que llamaremos inicial (Ver Solubilidad). Si enfriamos la solución Saturada, con el tiempo se formarán cristales de Sal, ésto se debe a que la solubilidad de la Sal en el Agua depende de la Temperatura y lo que fue una solución saturada a la temperatura inicial es ahora una solución sobre-saturada a la temperatura final. Es importante recalcar que una solución sobresaturada es un sistema metaestable y que tenderá a estabilizarse, mientras que una solución saturada es un sistema estable.
Para efectuar la Cristalización de un Sólido hay que partir de una Solución Sobre-Saturada. Existen varias formas de Sobre-Saturar una Solución, una de ellas es el enfriamiento de la solución, otra consiste en eliminar parte del Disolvente (Por ejemplo: por evaporación) a fin de aumentar la concentración del soluto, otra forma consiste en añadir un tercer componente que tenga una mayor solubilidad que el componente que se desea cristalizar.
La rapidez del Enfriamiento definirá el tamaño de los cristales resultantes. Un enfriamiento rápido producirá cristales pequeños, mientras que un enfriamiento lento producirá cristales grandes. Para acelerar la Cristalización puede hacerse una "siembra" raspando las paredes del recipiente.
g/mL = gramos por mililitro
g/L = gramos por litro
p.p.m. = partes por millón = mg/L, mg/kg, mL/L.
% P = (gramos de soluto)*(100)/ (gramos de Solución)
% V = (mL de soluto)*(100)/(mL de Solución)
% P/V = (gramos de soluto)*(100)/(mL de Solución)
M = Molaridad = moles/L
N = Normalidad = # equivalentes/L
X = Fracción Mol = moles de soluto/moles totales
g/L = gramos por litro
p.p.m. = partes por millón = mg/L, mg/kg, mL/L.
% P = (gramos de soluto)*(100)/ (gramos de Solución)
% V = (mL de soluto)*(100)/(mL de Solución)
% P/V = (gramos de soluto)*(100)/(mL de Solución)
M = Molaridad = moles/L
N = Normalidad = # equivalentes/L
X = Fracción Mol = moles de soluto/moles totales
sobresaturada
Se dice que una solución está sobresaturada cuando contiene más soluto que la cantidad soportada en condiciones de equilibrio por el disolvente, a una temperatura dada. Es por lo tanto una solución inestable, en la cual el exceso disuelto de depositará, aqui el factor temperatura es importante ya que no habrá remanente en caso la temperatura aumente lo suficiente como aumentar la solubilidad.
la solubilidad se mide en moles sobre litro, o gramos sobre litro, digamos... sal y agua, sal es el soluto y agua el solvente cierto? ok, que su solubilidad sea 250 gramos por cada litro a 25ºC entre el agua y la sal, 250 g/L nos indica que un litro de agua diluye 250 gramos de sal, ya, esa cantidad es lo maximo en gramos que puede solubilizar el agua a esa temperatura, si en 1000 ml de agua, que es un litro, agregas 251 gramos, por ese gramo en que se excede la solucion, ES SOBRESATURADA, porque ese gramo excedente no se va a disolver, sino va a quedar como un remanente. Ese es el concepto de solución sobresaturada, ahora si aumentas la temperatura, seguramente la solubilidad va a incrementarse, es decir, ya no va a ser 250 gramos (el supuesto) sino 280 300 gramos por litro.

la solubilidad se mide en moles sobre litro, o gramos sobre litro, digamos... sal y agua, sal es el soluto y agua el solvente cierto? ok, que su solubilidad sea 250 gramos por cada litro a 25ºC entre el agua y la sal, 250 g/L nos indica que un litro de agua diluye 250 gramos de sal, ya, esa cantidad es lo maximo en gramos que puede solubilizar el agua a esa temperatura, si en 1000 ml de agua, que es un litro, agregas 251 gramos, por ese gramo en que se excede la solucion, ES SOBRESATURADA, porque ese gramo excedente no se va a disolver, sino va a quedar como un remanente. Ese es el concepto de solución sobresaturada, ahora si aumentas la temperatura, seguramente la solubilidad va a incrementarse, es decir, ya no va a ser 250 gramos (el supuesto) sino 280 300 gramos por litro.
insaurada
ES UNA SOLUCION EN LA QUE EL SOLUTO NO LLEGO A SU CONCENTRACION MAXIMA,OSEA A SU CONCENTRACION DE SATURACION.
OSEA QUE ES UNA SOLUCION EN LA CUAL TODABIA ADMITE QUE SE SIGA SOLUBILIZANDO EL SOLUTO SIN QUE APAREZCAN PRESIPITADOS
Una solucion insaturada se obtiene cuando agregamos una cantidad de soluto (lo que se va a disolver) en una pequeña cantidad al solvente (lo que va a disolver), de modo tal que si deseamos adicionar mas adelante mas soluto al solvente este va a disolverse
Un ejemplo sencillo lo podemos ver cuando tenemos una jarra grande de agua y le adicionamos una cucharada de sal (con una cuchara de postre) y lo agitamos, se puede observar que la sal se disuelve sin ningun problema y que podemos adicionarle varias cucharadas mas; el agua tiene la capacidad de disolver una cantidad determinada de sal, o cualquier otro soluto, y esto esta determinado por la solubilidad de esa sustancia en ese solvente; o sea, la solubilidad de la sal en el agua nos dice la cantidad maxima de sal que podemos agregar a una cantidad de agua sin que nos quede sal en sin disolver.
OSEA QUE ES UNA SOLUCION EN LA CUAL TODABIA ADMITE QUE SE SIGA SOLUBILIZANDO EL SOLUTO SIN QUE APAREZCAN PRESIPITADOS
Una solucion insaturada se obtiene cuando agregamos una cantidad de soluto (lo que se va a disolver) en una pequeña cantidad al solvente (lo que va a disolver), de modo tal que si deseamos adicionar mas adelante mas soluto al solvente este va a disolverse
Un ejemplo sencillo lo podemos ver cuando tenemos una jarra grande de agua y le adicionamos una cucharada de sal (con una cuchara de postre) y lo agitamos, se puede observar que la sal se disuelve sin ningun problema y que podemos adicionarle varias cucharadas mas; el agua tiene la capacidad de disolver una cantidad determinada de sal, o cualquier otro soluto, y esto esta determinado por la solubilidad de esa sustancia en ese solvente; o sea, la solubilidad de la sal en el agua nos dice la cantidad maxima de sal que podemos agregar a una cantidad de agua sin que nos quede sal en sin disolver.
saturada
- En química, un compuesto saturado está formado por moléculas orgánicas que no contienen dobles enlaces ni triples enlaces carbono-carbono. Se piensa que la saturación de las grasas determina su capacidad de bloquear el sistema circulatorio de la sangre en el cuerpo.
- Una disolución saturada es la que contiene la mayor concentración de soluto posible en un volumen de disolvente dado y para cierta temperatura. Unasolución sobresaturada contiene más soluto del que puede ser disuelto en el disolvente a esa temperatura; normalmente se consigue al bajar la temperatura o por evaporación del disolvente en una solución saturada. En este caso, la adición de cristales de soluto puede provocar su precipitado.
Cuando una solución contiene "disuelto" más soluto del que puede disolver se dice que esta solución es una solución sobresaturada, la cual no es estable.
Un ejemplo de solución saturada es una solución de 37.5 gramos de NaCl(sal común) en 100 gramos de agua a 0ºC Cuando una solución contiene disuelto menos soluto del que puede disolver el solvente se dice que esta solución es no saturada.
Espero sea de utilidad!
El Agua Y Las Soluciones

La estequiometría es una parte de la Química encargada de estudiar las relaciones que existen entre las masas y volúmenes de las sustancias que participan en las reacciones químicas. Este tema implica la formulación y solución de problemas. Para poder resolver estos problemas, necesitamos conocer algunos conceptos fundamentales y sus aplicaciones.
El propósito de esta lección es conocer estos conceptos fundamentales que son los siguientes: peso atómico, átomo-gramo, peso molecular, mol, peso equivalente de un elemento y de un compuesto.
PESO ATÓMICO DE UN ELEMENTO QUÍMICO.- (P.at.) Como quiera que los elementos químicos son generalmente una mezcla de sus isótopos, es que debemos entender que todos los átomos que le constituyen no tienen la misma masa y por tanto el mismo peso; sin embargo, todos sabemos que a cada elemento químico le corresponde un peso atómico determinado, que no es sino el peso promedio de sus isótopos teniendo en cuenta sus porcentajes de abundancia en la naturaleza.
Según esta idea el peso atómico de un elemento se podría determinar con la siguiente fórmula, si se conocen las masas de cada uno de sus isótopos y los porcentajes de abundancia de cada uno de ellos:
El propósito de esta lección es conocer estos conceptos fundamentales que son los siguientes: peso atómico, átomo-gramo, peso molecular, mol, peso equivalente de un elemento y de un compuesto.
PESO ATÓMICO DE UN ELEMENTO QUÍMICO.- (P.at.) Como quiera que los elementos químicos son generalmente una mezcla de sus isótopos, es que debemos entender que todos los átomos que le constituyen no tienen la misma masa y por tanto el mismo peso; sin embargo, todos sabemos que a cada elemento químico le corresponde un peso atómico determinado, que no es sino el peso promedio de sus isótopos teniendo en cuenta sus porcentajes de abundancia en la naturaleza.
Según esta idea el peso atómico de un elemento se podría determinar con la siguiente fórmula, si se conocen las masas de cada uno de sus isótopos y los porcentajes de abundancia de cada uno de ellos:

Sin embargo, en todas las tablas periódicas, donde se consignan las características de los diferentes elementos químicos figuran los pesos atómicos relativos de los elementos químicos que se determinaron tomando como término de comparación a un isótopo del carbono que es el carbono-12.
El peso atómico relativo de un elemento se puede definir como el peso de dicho elemento que resulta de compararlo con la doceava parte del carbono-12 (C-12) al que por convención se le ha asignado el peso de 12,0000 uma (unidades de masa atómica).
Cada elemento químico se caracteriza por poseer un peso atómico concreto.
H = 1,008 .........................Cl = 35,453
C = 12,011 ........................Na = 22,9897
O = 15,9994 .....................S = 32,06
N = 14,0067 .....................Fe = 55,847
El peso atómico relativo de un elemento se puede definir como el peso de dicho elemento que resulta de compararlo con la doceava parte del carbono-12 (C-12) al que por convención se le ha asignado el peso de 12,0000 uma (unidades de masa atómica).
Cada elemento químico se caracteriza por poseer un peso atómico concreto.
H = 1,008 .........................Cl = 35,453
C = 12,011 ........................Na = 22,9897
O = 15,9994 .....................S = 32,06
N = 14,0067 .....................Fe = 55,847
Balanceo
Las ecuaciones químicas permiten conocer cuales son las sustancias que se combinan para formar productos, esto quiere decir las que se forman. La representación de una ecuación es por medio de la ecuación química, la cual esta constituida por reactivos y productos separados por una flecha. En la ecuación química el número de reactivos que se obtiene debe de ser la misma cantidad que de productos.
Balancear una ecuación es buscar que el número de átomos en el primer miembro con los del segundo se obtenga una igualdad por lo que es importante el uso de coeficientes, pero nunca se deberá alterar los subíndices.
BALANCEO DE ECUACIONES QUIMICAS POR EL METODO DE TANTEO
Para el balanceo de ecuaciones por el método de tanteo es importante conocer la Ley de la conservación de la masa que se enuncia del siguiente modo:En una reacción química, la suma de las masa de las sustancias reaccionantes es igual a la suma de las masas de los productos de la reacción.
Para igualar ecuaciones por este método han de compararse uno a uno los distintos elementos que figuran en la reacción. Si un elemento cualquiera, X, figura, por ejemplo, en el primer miembro con el subíndice 2 y en el segundo con 1, entonces, en principio, se ha de colocar el coeficiente 2 a la izquierda de la formula de segundo miembro que contiene el elemento X. Tal proceder se sigue sistemáticamente con los restantes elementos lo que obliga a veces a modificar alguno de los coeficientes ya escritos.
Igualase, por ejemplo, la reacción:
H2 + O2 H2O
El hidrogeno ya esta igualado, para ajustar el oxigeno es necesario colocar el coeficiente 2 a la molécula de H2O.
H2 + O2 2H2O
El balance, puesto que el coeficiente 2 afecta tanto al H como al O del agua, se deberá añadir el coeficiente 2 al H2 del primer miembro.
2H2 + O2 2H2O
Al establecer la misma cantidad de masa de los reactivos como en los productos se dice que la ecuación esta balanceada.
BALANCEO DE ECUACIONES QUIMICAS POR EL METODO DE OXIDO-REDUCCION
En el método de oxido reducción, también conocido como Redox, intervienen dos fenómenos. La oxidación y la reducción. La oxidación es la cesión de electrones por parte de los átomos de un elemento y la reducción es la ganancia de electrones.Para el balanceo por este método es importante conocer el Numero de oxidación este numero de un elemento representa su grado de oxidación = numero de electrones perdidos.
Para utilizar este método se siguen los siguientes pasos:
Suscribirse a:
Comentarios (Atom)