Los Métodos de Separación se basan en diferencias entre las propiedades físicas de los componentes de una mezcla, tales como: Punto de EbulliciónDensidad,, Presión de Vapor, Punto de Fusión, Solubilidad, etc. Los Métodos más conocidos son:
Filtración
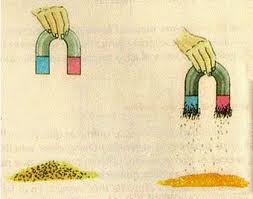
El procedimiento de Filtración consiste en retener partículas sólidas por medio de una barrera, la cual puede consistir de mallas, fibras, material poroso o un relleno sólido.
El procedimiento de Filtración consiste en retener partículas sólidas por medio de una barrera, la cual puede consistir de mallas, fibras, material poroso o un relleno sólido.
Decantación
El procedimiento de Decantación consiste en separar componentes que contienen diferentes fases (por ejemplo, 2 líquidos que no se mezclan, sólido y líquido, etc.) siempre y cuando exista una diferencia significativa entre las densidades de las fases.
La Separación se efectúa vertiendo la fase superior (menos densa) o la inferior (más densa).
El procedimiento de Decantación consiste en separar componentes que contienen diferentes fases (por ejemplo, 2 líquidos que no se mezclan, sólido y líquido, etc.) siempre y cuando exista una diferencia significativa entre las densidades de las fases.
La Separación se efectúa vertiendo la fase superior (menos densa) o la inferior (más densa).
Evaporación
El procedimiento de Evaporación consiste en separar los componentes mas volátiles exponiendo una gran superficie de la mezcla. El aplicar calor y una corriente de aire seco acelera el proceso.
El procedimiento de Evaporación consiste en separar los componentes mas volátiles exponiendo una gran superficie de la mezcla. El aplicar calor y una corriente de aire seco acelera el proceso.
Cristalización
Una Solución consta de dos componentes: El Disolvente y el Soluto. Las Soluciones pueden ser No-Saturadas, Saturadas y Sobre-Saturadas (Para ver un gráfico representando soluciones No-Saturadas, Saturadas y Sobre-Saturadas .
Las Soluciones No-Saturadas tienen una concentracion de soluto menor que las soluciones saturadas, y éstas a su vez tienen una concentración de solucto menor que una solución sobresaturada. Por ejemplo: Supóngase que se agregan unos cuantos cristales de Sal Común a un Vaso de Agua. Esta será una Solución No-Saturada. Si se sigue añadiendo Sal con agitación se llegará hasta un punto en el cual los cristales ya no se disuelven. Esta será una Solución Sobre-Saturada. Si esta solución se deja reposar y se remueven los cristales que no se disolvieron, se obtendrá una Solución Saturada que contendrá la cantidad máxima de soluto que se puede disolver a la temperatura actual que llamaremos inicial (Ver Solubilidad). Si enfriamos la solución Saturada, con el tiempo se formarán cristales de Sal, ésto se debe a que la solubilidad de la Sal en el Agua depende de la Temperatura y lo que fue una solución saturada a la temperatura inicial es ahora una solución sobre-saturada a la temperatura final. Es importante recalcar que una solución sobresaturada es un sistema metaestable y que tenderá a estabilizarse, mientras que una solución saturada es un sistema estable.
Para efectuar la Cristalización de un Sólido hay que partir de una Solución Sobre-Saturada. Existen varias formas de Sobre-Saturar una Solución, una de ellas es el enfriamiento de la solución, otra consiste en eliminar parte del Disolvente (Por ejemplo: por evaporación) a fin de aumentar la concentración del soluto, otra forma consiste en añadir un tercer componente que tenga una mayor solubilidad que el componente que se desea cristalizar.
La rapidez del Enfriamiento definirá el tamaño de los cristales resultantes. Un enfriamiento rápido producirá cristales pequeños, mientras que un enfriamiento lento producirá cristales grandes. Para acelerar la Cristalización puede hacerse una "siembra" raspando las paredes del recipiente.
Una Solución consta de dos componentes: El Disolvente y el Soluto. Las Soluciones pueden ser No-Saturadas, Saturadas y Sobre-Saturadas (Para ver un gráfico representando soluciones No-Saturadas, Saturadas y Sobre-Saturadas .
Las Soluciones No-Saturadas tienen una concentracion de soluto menor que las soluciones saturadas, y éstas a su vez tienen una concentración de solucto menor que una solución sobresaturada. Por ejemplo: Supóngase que se agregan unos cuantos cristales de Sal Común a un Vaso de Agua. Esta será una Solución No-Saturada. Si se sigue añadiendo Sal con agitación se llegará hasta un punto en el cual los cristales ya no se disuelven. Esta será una Solución Sobre-Saturada. Si esta solución se deja reposar y se remueven los cristales que no se disolvieron, se obtendrá una Solución Saturada que contendrá la cantidad máxima de soluto que se puede disolver a la temperatura actual que llamaremos inicial (Ver Solubilidad). Si enfriamos la solución Saturada, con el tiempo se formarán cristales de Sal, ésto se debe a que la solubilidad de la Sal en el Agua depende de la Temperatura y lo que fue una solución saturada a la temperatura inicial es ahora una solución sobre-saturada a la temperatura final. Es importante recalcar que una solución sobresaturada es un sistema metaestable y que tenderá a estabilizarse, mientras que una solución saturada es un sistema estable.
Para efectuar la Cristalización de un Sólido hay que partir de una Solución Sobre-Saturada. Existen varias formas de Sobre-Saturar una Solución, una de ellas es el enfriamiento de la solución, otra consiste en eliminar parte del Disolvente (Por ejemplo: por evaporación) a fin de aumentar la concentración del soluto, otra forma consiste en añadir un tercer componente que tenga una mayor solubilidad que el componente que se desea cristalizar.
La rapidez del Enfriamiento definirá el tamaño de los cristales resultantes. Un enfriamiento rápido producirá cristales pequeños, mientras que un enfriamiento lento producirá cristales grandes. Para acelerar la Cristalización puede hacerse una "siembra" raspando las paredes del recipiente.
g/mL = gramos por mililitro
g/L = gramos por litro
p.p.m. = partes por millón = mg/L, mg/kg, mL/L.
% P = (gramos de soluto)*(100)/ (gramos de Solución)
% V = (mL de soluto)*(100)/(mL de Solución)
% P/V = (gramos de soluto)*(100)/(mL de Solución)
M = Molaridad = moles/L
N = Normalidad = # equivalentes/L
X = Fracción Mol = moles de soluto/moles totales
g/L = gramos por litro
p.p.m. = partes por millón = mg/L, mg/kg, mL/L.
% P = (gramos de soluto)*(100)/ (gramos de Solución)
% V = (mL de soluto)*(100)/(mL de Solución)
% P/V = (gramos de soluto)*(100)/(mL de Solución)
M = Molaridad = moles/L
N = Normalidad = # equivalentes/L
X = Fracción Mol = moles de soluto/moles totales
No hay comentarios:
Publicar un comentario